1. 神経活動の観察手段としての膜電位感受性色素の特徴
本論に入る前に、脳・神経の活動を観察する方法について考えてみよう。神経活動の実体は神経細胞の膜電位(membrane potential)の急激な変化であるが、観察手法によって、個々の膜電位を反映した観察ができるものから、分解能は良くなくても全体的な内容が把握できる方法が開発されてきた。
まず、測定の対象である神経活動と膜電位について簡単に説明しておこう。神経細胞はイオンの濃度差をポテンシャルにし電気的に分極している。静止状態では約60mVの電位差で、細胞の内側は外側に比べ負に分極している。これを過分極状態といい、その電位を静止電位という。神経が活動すると、NaやCaイオンが細胞内に流入し、電位の逆転が起こり、瞬間的(1msec程度)に細胞内の電位は約50mV正に分極する。これを脱分極といい、この瞬間的な電位を活動電位あるいはスパイクという。また、神経活動が神経細胞から神経細胞に伝播されるとやや遅い(10msec程度)シナプス電位が発生するが、その大きさは約20mVである。
図1に示すのは、神経活動計測の代表的な方法とその特徴をまとめた図である。どの方法も神経活動を計測する手段ではあるが、観察できる内容は微妙に異なる。図1Aの内部電極法はガラスピペットにKClなどの電解質をつめた電極を、文字どおり細胞内に刺入することで、神経細胞の膜電位を計測する方法である。したがって、最も精度が高い計測が可能である。
そのような神経細胞のすぐ側に金属製の電極を当てると、スパイクの発生に伴い生じる局所イオン電流を観察できる。それが図1Bの外部電極法であり、タングステンワイヤーなどを研磨した先端の鋭い電極を用いて、単一の神経細胞の活動が計測できる。内部電極に比べて絶対精度は低下するが、同じ電極を動かすことによって、多数の神経細胞からの活動を観察することが可能である。おもに、生きた動物の脳活動を観察するのに用いられる。
それに対して、図1Cのように先端を丸めた電極を脳の表面やスライスの表面に密着させると、近傍の多くの神経細胞から生じるイオン電流の和が観察できる。この表面電極法が良いところは、内部・外部電極法は非常に位置に敏感で一般にむずかしい技術であるのに対して、位置に鈍感で、取扱いが簡単なところである。しかし、細胞レベルでの時間・空間分解能はないという問題点がある。
そして、図1Dの膜電位感受性色素(voltage sensitive dye)を用いた光学的方法がこの節の主題である。上記の説明のごとく、神経細胞の活動とは電気的変化であるので、細胞膜を電圧感受性色素と呼ばれる特殊な色素で染め、電気変化を光変化に変換し映像で捉えることができる。
もともとの神経活動は前述の活動電位(100mV/1msec)とシナプス電位(20mV/10msec)であり、両者が混ざった膜電位変化を色素のはたらきで可視化することができる。図1Eに示したのは、ヤリイカ巨大神経軸際の活動電位を内部電極法(実線)と膜電位感受性色素の光量変化を重ねてプロット(離散点)した図である。このように、単一神経細胞膜を対象とする場合、両者は相対的に非常に良く一致する。つまり、この手法の最大の利点は計測している内容は、内部電極法が測定している直接の神経活動であるということであり、一般的に難しく、熟練を要する電極刺入にかかわる困難さがなく、セットアップさえ整えば初心者でも簡単に再現性の高い観測が可能であることである。しかも、光学的な倍率(対物レンズの焦点距離)によって、また、試料によっても状況は異なるが、細胞レベルの信号を2次的に1,000点以上同時観察できる唯一の方法である。
しかし、良いところばかりではない。この方法の最大の問題点は、電圧感受性色素による光量変化が非常に小さい(0.1~1%)ため、ノイズが多いことである。この問題点については後で詳しく議論するが、実用上はさまざまな計測範囲の制限として現れる。たとえば、細胞レベルの分解能があるといっても、1つ1つの細胞を特定して観察するには、最低でも10回以上の平均加算により雑音を低減する必要がある。また、生きた動物に適応する場合、鼓動や呼吸により振動が及ぼすノイズが大きな問題となる。
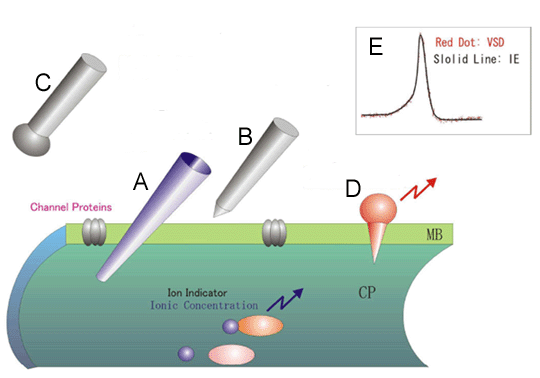
図は神経膜の一部を拡大して、模式的に示したイメージ図である。内部電極法(A)は、神経膜を貫くガラス電極により神経膜電位を直接観察する。それに対し外部電極法(BとC)では、神経興奮によるイオン電流を細胞外から観察する。Bは神経膜に接触して活動電位単位の記録をするもので、先端の鋭いタングステン電極などが用いられ、Cのように銀などの先端を丸めたものを外部電極として用いると集合電位(電流)が観察できる。膜電位感受性色素(D)は、分子プローブであり、神経膜に入り込んで膜電位を蛍光強度に変換する。Eに示した図は、ヤリイカ巨大神経軸策の活動電位であり、黒の実線が内部電極による測定、赤のドットが膜電位感受性色素による測定結果である。
以上のように、電圧感受性色素を用いた光学測定法は、電極法などと同様に神経活動そのもの(電気信号)を実時間で観察する手段であり、電極法では不可能な多点計測を実現する手法であるといえる。この適応範囲を示すのが図2である。
光学系の倍率を変えることで、器官レベルから細胞以下のレベルまでを適応範囲にできる。おそらく、現状で最も盛んなのは、1~3倍のレンズ系で、神経回路網(neural network)のはたらきを観察することであり、未知の神経回路を簡単に観察することができる。たとえば、遺伝子に欠陥を与えたモデル動物(ノックアウトマウスなど)の未知の脳を観察するという研究には強力な武器になると期待されている。
また、それより高い倍率(10倍以上)の光学系で、神経細胞1個の内部で電気信号がどのように発生し、伝播するかという研究も地味でむずかしい課題であるが、神経細胞の機能分子などのはたらきを解明するうえで重要である。逆に、1倍以下の低い倍率のレンズによって、脳の表面を露出させた動物などを用いた研究の成果も著しく、脳内部でのダイナミックな情報表現の解明はこの手法の独壇場である。また脳神経に限らず、心筋や副腎の電気的興奮を観察する有効な手段として応用が始まっている。
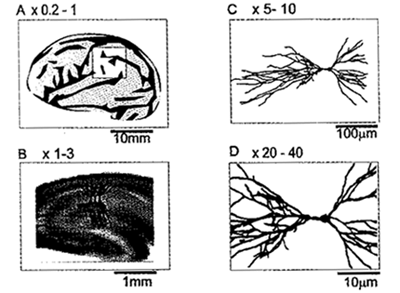
光学系の倍率と観察対象を対比した図である。縮小系のレンズ(A, 0.2~1倍)では脳全体や脳の一部が、低倍率レンズ(B, 1~3倍)では、神経回路網、さらに倍率を上げると、細胞1個(C)や、シナプス部分までの解像力(D)が得られる。
2. 計測の問題点―ノイズと信号
前項で述べたように、この手法は非常に有用であり、それほど難しい技術でもない。しかしながら、多くの知識とノウハウがなければ十分な計測結果は得られない。たとえば、ノイズを小さくしたいのであれば、光を明るくすれば当然よい。しかし、強烈な照明は、色素の変性と試料のダメージを誘起して、結果として正しい計測が果たせないのである。膜電位感受性色素を用いた計測で良い結果を得るには、いかに照明を抑え、いかに染色を抑え、それでいて、いかに明るい映像を捉えることを可能にするか、という問題にこたえることである。当然、そこには大いなる努力に基づいた妥協が必要である。
まず、ノイズと信号、光強度の関係を図3に示したので参照してほしい。この図の横軸は色素の発する蛍光の総量で、縦軸は蛍光の変化成分であり、どちらも対数軸である。数値はわれわれの用いているセンサーの1個のピクセル(約35μm角)に露光される光の光量子数である。2本の45度の黒の実線は、神経の活動によって代表的な膜電位感受性色素(Di4-ANEPPS)が変化する信号を示し、上が1%のラインで、下が0.1%のラインである。
試料によって信号の大きさにはバリエーションがあるが、多くの場合、0.2%とか、0.6%といった値になり、この2本の直線の間に入る。計測装置自身がもっているノイズは一般に光量とは無関係なので、赤の点線で示したような水平な直線になる。これより、暗い領域の観察はほとんど無理であるが、多くの場合、このラインを超えるのは容易である。実際上、最も問題となるノイズは、赤の破線で示した光量の平方根で増加する光ショットノイズである。光ショットノイズは、光の粒子性(光子)に基づく雑音であり、物理的にさけようがないノイズである。このラインの上ならば、信号がノイズを上回り、S/N比は1以上ということになる。図中*で示した領域が、実質的にS/N=1程度の領域である。当然、これより右の明るい領域ならば、より良いS/N比で計測が可能である。
ところが、問題はそのような明るい光学系(蛍光顕微鏡)が存在しないことである。明るくするためには照明を強くすることになるが、試料に対するダメージが大きくなる。ごく一般的な蛍光顕微鏡などで得られる蛍光量は、図3右下のeasyという矢印が示す範囲で、特別に開口率の高いレンズを工夫した場合に、high NAの矢印で示す蛍光量が実現できる。それより、明るいものは現状では存在せず、明るくするためには照明の光源を強くする以外にない。
普通、100~150Wのハロゲン電球を光源に用いるが、500W級の光源に変更しても、3~5倍程度の輝度向上であり、S/Nの改善は平方根なのでせいぜい2倍程度である。ところが、試料のダメージは照明に対し線形かそれ以上に悪化するので、経験的に10倍程度は悪化する。つまり、2倍の改善を10倍の犠牲で得ることになる。もちろん、1回だけでも高いS/N比で観察ができれば目的を達成できるという実験ならば、躊躇なく強烈な光源を用意すべきだろう。しかし、多くの場合は、長時間安定な計測を前提にした実験の組み立てになるのも事実である。
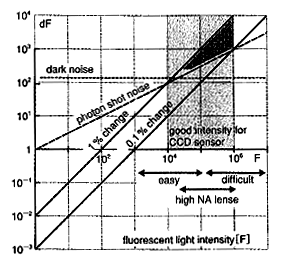
横軸はセンサーの1画素に飛び込む蛍光量を示し、縦軸はその変化成分である。2本の実線が信号であり、破線がノイズである。ノイズより信号が上回る領域(*印)ではS/N=1程度の観察が可能である。
我々の研究室で経験的に見出したラット・マウス大脳スライス標本で有効な染色法を紹介する。
経験的に見出された有効な染色法
- Di4-ANEPPS(5mg)のビンに、1mlのアルコールを直接入れて、よく溶解する。
(カタログにはメタノールとあるが、エタノールの方がよく溶ける) - そこに、クレモフォア-EL10%水溶液を0.5ml加えて、よく溶解してストック液とする。冷蔵庫で2~3か月は保存可能。
- 上記のストック液35μmを0.5ml仔ウシ血清と0.5mlのACSFに溶かして、染色液にする。最終濃度は約0.1mg/mlである。
- スライスは、インターフェースチェンバーのような状態を保つことができる密閉型の染色容器を作り、上記の染色液をスライスの表面に少量ずつ滴下して、約20分間静置する。温度は室温、容器内部でACSFを5%二酸化炭素・酸素ガスをパブリングして、酸素と湿気を保つ。
- スライスを観察チェンバー(サブマージュ型、顕微鏡の下に設置)に運び、約30分間インキュベートしてから観察に入る。
- この方法で、約4時間程度は安定な観察ができる。
3. 明るい光学系と高速カメラシステム
光学系の明るさは、おもに対物レンズの開口数(NA)による。開口数が倍になると、受光系で4倍、照明系で4倍、合計で16倍明るい映像が撮影できる。つまり、明るさは開口数の4乗に比例する。
開口数が高いレンズとは、大口径で焦点距離が短いということである。したがって、被写体から広がる光を広角に捉えるので明るい。市販の顕微鏡レンズの場合、40倍で0.7程度、20倍で0.3程度、10倍では0.1程度のものが一般的である。しかし、図2のように、最も用途の多い神経回路の観察などでは、1~3倍の低倍の光学系が必要になる。
多くの顕微鏡メーカーの販売する2倍レンズの開口数は0.05程度で、きわめて暗い。そこで、われわれは図4に示したような特別な光学系を作製して使用している。対物レンズはニコン製の一眼レフレンズ(F1.2、50mm 標準レンズ)を解体して余分な部品(絞りや焦点調整機構)を取り除きケースに収め再組立てしたものを使用している。このレンズの開口数は約0.7である。市販の顕微鏡レンズに比べて、200倍明るい映像が得られる。
この自作の顕微鏡は、高い開口数のレンズを2つ用いて、いわゆる無限遠設計になっている。ダイクロイックミラーの置かれる本体部分はほぼ平行な光束が通り、投影レンズを経てCCDセンサーに結像される。投影レンズにはライカ製の80mmの実体顕微鏡レンズを用いている。総合倍率は約1.6倍である。590㎚以上の長波長のみを通す吸収フィルターを配置した。
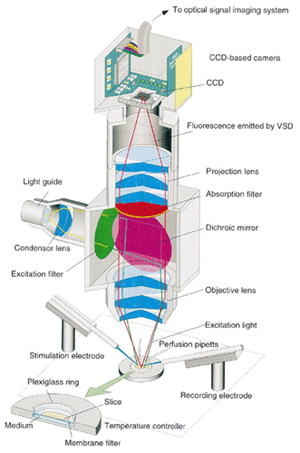
図4 光学系は開口数が大きな対物レンズを中心に組み上げた自家製の同軸落射蛍光顕微鏡である。黄色の線で示したのが照明光であり、赤で示したのが蛍光光である。両者の分離にはダイクロイックミラーを用いる。この顕微鏡が明るい理由は、カメラレンズ(Nikon F1.2, 50mm)を解体して作った対物レンズにある。その下に試料である脳のスライスを置き、電極などをセットする。総合倍率は約1.6倍。
照明系には市販の150Wハロゲン電球を用いたファイバー照明器具(モリテックス製、MHF-G150)を用いている。色素の波長特性に合わせるため、照明は干渉フィルターを通し、緑色光(530nm)にしている。ダイクロイックミラーは、530nmの光を90%以上反射し、試料に投下される。試料での蛍光のうち、590~650nmの光が電圧感受成分なので、これを効果的に切り出すため、ダイクロイックミラーは590~650nmの光を90%以上透過し、その後、迷走光を遮るため590nm以上の長波長のみを通す吸収フィルターを配置した。
カメラシステムは、われわれの研究室とブレインビジョン社で開発した高速CCD撮影システムである。このカメラに使用しているCCDセンサーはSONYのICX076という通常用途の白黒CCDイメージセンサーである。普通は、7MHz程度のクロックで動作させるべき部品であるが、強引に50MHzで動作させ、さらに、縦方向(V方向)のCCD転送クロックを4回連続で与え、縦の走査線数を60本にまとめることで高速に動作させている。結果として、約700μsecで全画面の読み出しが可能である。神経活動が1msec程度であることを考慮すると700μsec必ずしも十分な速度ではないが、おおむね要求を満たす速度である。
このCCDセンサーは1/5インチサイズで、有効受光面はおおむね3mm×2mmほどである。小型なため、蓄積可能な電荷量が少ないのがやや不満な点であるが、ここまで高速動作が可能なのは、小さいためなので納得している。CCDセンサーで捉えられた映像は高速ADCを経て、デジタル処理によって加工・保存される。映像データは一時的にメモリーに貯え、計測直後にPCIバスを介してホストコンピュータに転送される。
4. 計測結果
前項で紹介したカメラシステムと光学系を用いて、脳を生きたままスライスして得た試料をDi-4-ANEPPS色素で染色して、小さな電気刺激を与えたときの観測結果を図5に示す。
図5Aに示したのは、摘出したラット脳に対する観測部位と電極などの配置を示した図である。観測領域は海馬の中でもCA1と呼ばれる部分である。刺激電極をCA1領域のおもな入力線維であるシェーファー側枝に配置し、短いパルスで電気刺激する。刺激はシェーファー側枝を通じて、CA1の錐体細胞を次々に興奮させていく。その様子が、図5Cからよくわかる。
この映像は、もともと0.75msec単位で測定されているが、図の都合で1枚おき、すなわち1.5msecごとの映像を示した。本来、膜電位感受性色素の神経興奮による変化は0.3%程度なので、コンピュータ処理により変化成分だけを約300倍に強調し、赤い色をつけて映像にスーパーインポーズして示した。赤の濃い部分がより脱分極している部位である。このように、実時間で膜電位を2次元でイメージングできるのが、この方法の最大のメリットである。
さらに、図5Bに示したのは、スライスの任意の点(この場合CA1の錐体細胞の各場所に当たる4ヵ所)を選び、その点での神経活動を時間方向に解析した表示である。これはちょうど、複数の内部電極を刺したときとほぼ等価であるが、実際には、同時に映像として記録した各画素のデータを読み取ったものである。つまり、この画像上の任意の点に内部電極が存在していると思えばよい。
図5Bで、4つのトレースの下に示したノイズの少ない実線は、内部電極で記録した活動電位であり、赤い小さな丸で示したのは、ほぼ同じ場所の光計測の結果である。このように、ほとんど同じ波形が得られることがわかる。しかし、よく見ると、活動電位のピークに比較して、遅い成分が光計測ではやや大きめに写る。これには、①光で観察される活動電位はいくつかの細胞の平均値なので、速い活動電位は同期性が悪く、実際よりも小さめに観察される、②膜電位感受性色素の測定量は膜電位と同様に膜の密度にも比例する。
この試料では、神経細胞膜の密度がデンドライトで高く、細胞体で低いため、デンドライトの成分が混じるとシナプス電位成分が強調される、という2つの理由が考えられる。膜電位感受性色素を用いた研究では、組織による染色性の違いやアクティブな膜の密度について考慮する必要がある。なお、一部色素(たとえば、RH-155)は、神経細胞よりもグリアによく取り込まれるため、グリアの比較的遅い分極がデータに混入することが知られている。この測定に用いたDi-4-ANEPPSは、神経細胞の活動に依存する蛍光変化がほぼ全てであり、グリア活動はほとんど見えない。まったく新しい試料の場合には、使用する色素との相性などを調べてから詳しい実験に進むべきである。
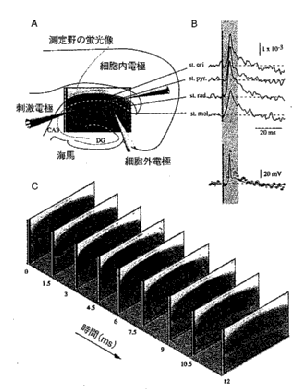
図5 ラット脳より海馬を摘出し、約400μmの厚みにスライスし、Di4-ANEPPSにて染色した。観察部位はCA1(図Aを参照)であり、刺激はCA3からCA1に投射するシェーファー側枝に電流を流す。図Bに示したのは、図Aに線で示された各部分の画素の蛍光変化量を時間でプロットしたものである。図B下のパネルに示したのは内部電極で計った膜電位(実線)とほぼ同じ場所の光計測の点(赤丸)を重ねて示している。Cは、各図の左下の時間(msec単位)の映像を並べたものである。この図のデータは、8回のアベレージングとS/N改善のためのフィルター処理を施してある。
おわりに
膜電位感受性色素による神経興奮活動の計測は、いくつかのポイントをつかめば、難しい方法ではない。また、この技術は歴史的には古く、すでに開発されて20年が経過している。しかしながら、いまだに一般に難しい技術と考えられている。その理由は、計測に適したカメラシステムが入手困難なことと、システマティックに安定な計測を実現する地道なデータの積み重ねが後になり、派手な結果を求めてきたためではないかと反省する。
われわれの研究の1つの方向性は、誰でも可能な光計測技術を完成することである。それと同期して、世界中の研究機関で、GFP(クラゲ由来の緑色蛍光タンパク質)をチャネルタンパク質に遺伝子レベルで導入する研究も進展している。近い将来、生まれながらに電飾することなく膜電位で蛍光変化する脳をもつ実験動物が誕生する可能性がある。そうなれば、一気に普及することになるだろう。
さて、今のところ、ヒトを対象とした医療診断に実施例はない。その最大の理由は、MRIのようにまったく無侵襲な手法と異なり、診断する部位が見える状態でないとならないからである。また、色素の毒性も少ないとはいえ、安全とは言い切れない。しかしながら、米国の医科系大学を中心に心臓手術や脳外科手術の現場で確度を高めるための補助的な手段としての応用を検討していると聞く。何年か先には、多くの生命を救える手法に発展するかもしれない。その日の到来をねがって、本節の結びとしたい。
(出典: 共立出版 「光による医学診断」(2001年3月30日出版))
