1. 神経活動の観察手段としての膜電位感受性色素の特徴
ブレインビジョン株式会社 市川道教
本論に入る前に、脳・神経の活動を観察する方法について考えてみよう。神経活動の実体は神経細胞の膜電位(membrane potential)の急激な変化であるが、観察手法によって、個々の膜電位を反映した観察ができるものから、分解能は良くなくても全体的な内容が把握できる方法が開発されてきた。まず、測定の対象である神経活動と膜電位について簡単に説明しておこう。神経細胞はイオンの濃度差をポテンシャルにし電気的に分極している。静止状態では約60mVの電位差で、細胞の内側は外側に比べ負に分極している。これを過分極状態といい、その電位を静止電位という。神経が活動すると、NaやCaイオンが細胞内に流入し、電位の逆転が起こり、瞬間的(1msec程度)に細胞内の電位は約50mV正に分極する。これを脱分極といい、この瞬間的な電位を活動電位あるいはスパイクという。また、神経活動が神経細胞から神経細胞に伝播されるとやや遅い(10msec程度)シナプス電位が発生するが、その大きさは約20mVである。
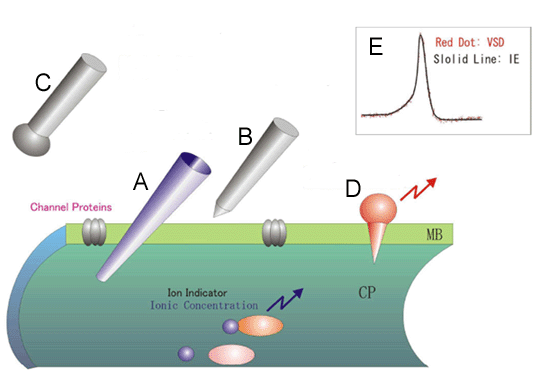
図1に示すのは、神経活動計測の代表的な方法とその特徴をまとめた図である。どの方法も神経活動を計測する手段ではあるが、観察できる内容は微妙に異なる。図1Aの内部電極法はガラスピペットにKClなどの電解質をつめた電極を、文字どおり細胞内に刺入することで、神経細胞の膜電位を計測する方法である。したがって、最も精度が高い計測が可能である。そのような神経細胞のすぐ側に金属製の電極を当てると、スパイクの発生に伴い生じる局所イオン電流を観察できる。それが図1Bの外部電極法であり、タングステンワイヤーなどを研磨した先端の鋭い電極を用いて、単一の神経細胞の活動が計測できる。内部電極に比べて絶対精度は低下するが、同じ電極を動かすことによって、多数の神経細胞からの活動を観察することが可能である。おもに、生きた動物の脳活動を観察するのに用いられる。それに対して、図1Cのように先端を丸めた電極を脳の表面やスライスの表面に密着させると、近傍の多くの神経細胞から生じるイオン電流の和が観察できる。この表面電極法が良いところは、内部・外部電極法は非常に位置に敏感で一般にむずかしい技術であるのに対して、位置に鈍感で、取扱いが簡単なところである。しかし、細胞レベルでの時間・空間分解能はないという問題点がある。
そして、図1Dの膜電位感受性色素(voltage sensitive dye)を用いた光学的方法がこの節の主題である。上記の説明のごとく、神経細胞の活動とは電気的変化であるので、細胞膜を電圧感受性色素と呼ばれる特殊な色素で染め、電気変化を光変化に変換し映像で捉えることができる。
もともとの神経活動は前述の活動電位(100mV/1msec)とシナプス電位(20mV/10msec)であり、両者が混ざった膜電位変化を色素のはたらきで可視化することができる。図1Eに示したのは、ヤリイカ巨大神経軸際の活動電位を内部電極法(実線)と膜電位感受性色素の光量変化を重ねてプロット(離散点)した図である。このように、単一神経細胞膜を対象とする場合、両者は相対的に非常に良く一致する。つまり、この手法の最大の利点は計測している内容は、内部電極法が測定している直接の神経活動であるということであり、一般的に難しく、熟練を要する電極刺入にかかわる困難さがなく、セットアップさえ整えば初心者でも簡単に再現性の高い観測が可能であることである。しかも、光学的な倍率(対物レンズの焦点距離)によって、また、試料によっても状況は異なるが、細胞レベルの信号を2次的に1,000点以上同時観察できる唯一の方法である。しかし、良いところばかりではない。この方法の最大の問題点は、電圧感受性色素による光量変化が非常に小さい(0.1~1%)ため、ノイズが多いことである。この問題点については後で詳しく議論するが、実用上はさまざまな計測範囲の制限として現れる。たとえば、細胞レベルの分解能があるといっても、1つ1つの細胞を特定して観察するには、最低でも10回以上の平均加算により雑音を低減する必要がある。また、生きた動物に適応する場合、鼓動や呼吸により振動が及ぼすノイズが大きな問題となる。
図1 神経活動計測の手法
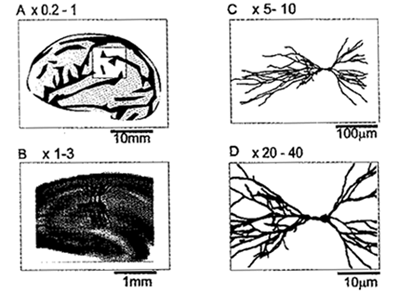
以上のように、電圧感受性色素を用いた光学測定法は、電極法などと同様に神経活動そのもの(電気信号)を実時間で観察する手段であり、電極法では不可能な多点計測を実現する手法であるといえる。この適応範囲を示すのが図2である。光学系の倍率を変えることで、器官レベルから細胞以下のレベルまでを適応範囲にできる。おそらく、現状で最も盛んなのは、1~3倍のレンズ系で、神経回路網(neural network)のはたらきを観察することであり、未知の神経回路を簡単に観察することができる。たとえば、遺伝子に欠陥を与えたモデル動物(ノックアウトマウスなど)の未知の脳を観察するという研究には強力な武器になると期待されている。また、それより高い倍率(10倍以上)の光学系で、神経細胞1個の内部で電気信号がどのように発生し、伝播するかという研究も地味でむずかしい課題であるが、神経細胞の機能分子などのはたらきを解明するうえで重要である。逆に、1倍以下の低い倍率のレンズによって、脳の表面を露出させた動物などを用いた研究の成果も著しく、脳内部でのダイナミックな情報表現の解明はこの手法の独壇場である。また脳神経に限らず、心筋や副腎の電気的興奮を観察する有効な手段として応用が始まっている。
図2 膜電位感受性色素を用いた光計測の適応範囲
(出典 共立出版 「光による医学診断」(2001年3月30日出版))
2. 計測の問題点―ノイズと信号 >